Лекция №1 Введение. Изотермические и адиабатические химические превращения. Роль тепловыделения. Самовоспламенение. Тепловой и цепной механизм. 1. Введение. Роль тепловыделения. - О лекциях по кинетике химической реакции - что мы изучили: -Пожалуй, самое
главное - это зависимость
скорости реакции
Где: k -
константа скорости химической
реакции, Если
экзотермические химические
превращения есть условия для
роста Т (или
"размножения" активных
частиц), то Проявляется это как вспышка (“взрыв”) и сопровождается появлением пламени. Этот процесс называется - воспламенением - (возникновение самоускоряющейся химической реакции в результате теплового или цепного механизма). В воспламенении часто трудно отделить роль Т и активных частиц. Иногда в процессе развития реакции ведущая роль переходит от одного явления к другому: чаще от активных частиц к тепловыделению, поскольку экспоненциальная зависимость сильнее, чем степенная. Горение - это самоускоряющаяся химическая реакция, в основе самоускорения которой лежит выделение тепла и (или) активных химических частиц и образование положительной обратной связи и которая в результате физических факторов: процессов переноса (теплопроводность, диффузия, конвекция, излучение) способна к распространению в пространстве. В целом в курсе ФГ мы должны рассмотреть два основных явления:
Естественно - для различных топлив, видов горения и режимов распространения Чтобы отразить особенность процесса воспламенения уточним разницу между изотермической и адиабатической химическими реакциями. 2.Изотермические и адиабатические химические превращения. С точки зрения химического превращения наиболее общее (и потому неконкретное) условие воспламенения это
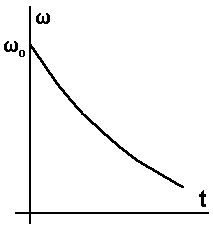
Рассмотрим изотермические химические реакции. Изотермическим - называется процесс, в результате которого Т системы остается постоянной. Как мы видели в
курсе КХР для них
Скорость реакции падает по мере протекания реакции и расходования исходных веществ. Максимальная Рассмотрим адиабатические химические реакции. Адиабатическим - называется такой процесс, в течении которого не происходит выделение тепла в окружающую среду.
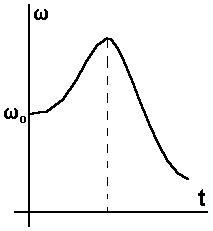
Рис.1. Даже при самом
малом выделении тепла в
результате зависимости Условие окончания
роста и перехода от роста к
спаду Чтобы учесть выгорание, введем величину "глубина химического превращения" — a (эта величина изменяется от 0 - в начале реакции до 1 - в конце, когда все израсходовано) - отношение количества прореагировавшего вещества к начальному количеству. Скорость химической реакции есть функция от a и Т:
тогда:
Здесь: Тогда
Подставляя (4) в (3) с
учетом того, что (
Граница перехода
между ростом и спадом
Реакция
ускоряющаяся ( Так как Физически это означает, что увеличение скорости адиабатической химической реакции за счет повышения Т должно превосходить уменьшение скорости за счет выгорания. Обычный ход
изменения
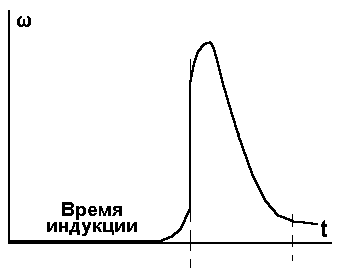
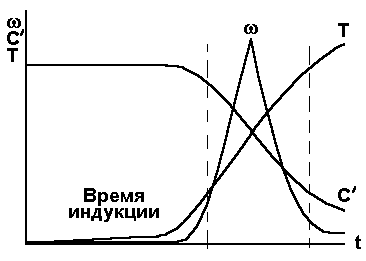
Рис. 2. В целом график включает в себя период малозаметного хода реакции, резкий рост скорости химической реакции и ее относительно медленный спад. Время, в течение которого реакция непосредственно не наблюдается, называется - временем индукции.
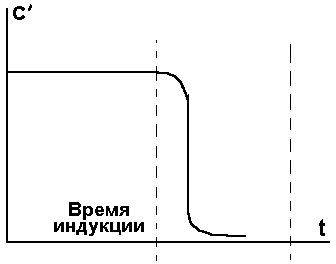
Рис. 3.
Рис. 4. Зависимость с',Т и w от t 3.Два типа воспламенения. Самовоспламенение. Дальше мы будем говорить воспламенение (а не взрыв), они отличаются только нашим восприятием, по характеру разрушений. Если говорить только о тепловом механизме воспламенения, то можно говорить о двух типах воспламенения (об этом говорит опыт). Определяются они граничными условиями нагрева системы. 1.Вся горючая смесь
"равновесно" (нет grad
T в смеси) нагревается до Т*,
выше которой она
самостоятельно, без внешнего
воздействия, воспламеняется
(взрывается!) ( 2.Нагрев до Т** осуществляется в ограниченной области горючей смеси ("точке", плоскости), существует grad T. Неравновесный нагрев смеси. Воспламенение в этом случае сначала происходит в ограниченной области (точке, плоскости). Воспламенение других областей происходит посредством распространения зоны воспламенения (горения).
О безусловности разделения данных режимов в теории. Если ввести: t(Т) - время тепловой релаксации системы (выравнивания Т), t(хр)- время химической реакции (роста Т), то: 1. При t(Т) ~ t(хр) подведенное тепло успевает распределится по всему объему, реакция инициируется (ускоряется) одновременно во всех точках (на практике СВ происходит в области с наихудшими условиями теплоотвода: в центре сосуда, или в области наилучшего накопления тепла: в верхней части сосуда) 2. При t(Т) >> t(хр) зажигание (тепло не успевает распределиться по объему) 3. При t(Т) << t(хр) вообще нет воспламенения Характеристики этих двух типов воспламенения значительно различаются, но общим является важность теплового фактора. Будем рассматривать именно тепловой фактор, хотя из курса КХР известно, что бывает и цепное воспламенение. |
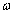 от
состава (1) и температуры Т
(закон Аррениуса(2)):
от
состава (1) и температуры Т
(закон Аррениуса(2)):